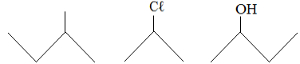
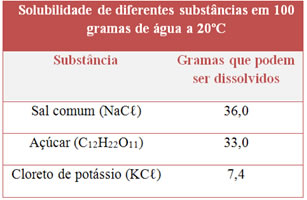
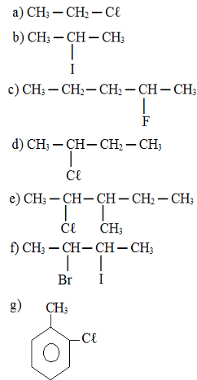Completa-se corretamente a afirmação acima quando X e Y são substituídos, respectivamente, por:
a) 1, 2, 3- propanotriol e triálcool.
b) álcool propílico e triálcool.
c) propanotrial e trialdeído.
d) éter propílico e poliéter.
e) 1, 2, 3- tripropanol e trialdeído.